In der modernen Industriegesellschaft ist Stahl aufgrund seiner vielseitigen Eigenschaften und seiner Recyclingmöglichkeiten der Basiswerkstoff für eine nachhaltige Entwicklung der Gesellschaft. Er hat große Einsatzbreite in fast allen wichtigen Industriesektoren: Apparate- und Maschinenbau, Brückenbau, Stahlhochbau, Energie- und Umwelttechnik, Transport und Verkehr, Verpackungsindustrie usw
Die Weltrohstahlerzeugung stieg von 40 Mio. t im Jahr 1900 auf über 1,3 Mrd. t an. Deutschland war bis 2002 der größte Stahlproduzent der Welt. Seitdem wird von China die Position des größten Stahlerzeugers eingenommen. Stahl ist und bleibt auch in diesem Jahrhundert der Werkstoff Nr. 1 mit dem besten Preis – Leistungs – Verhältnis.
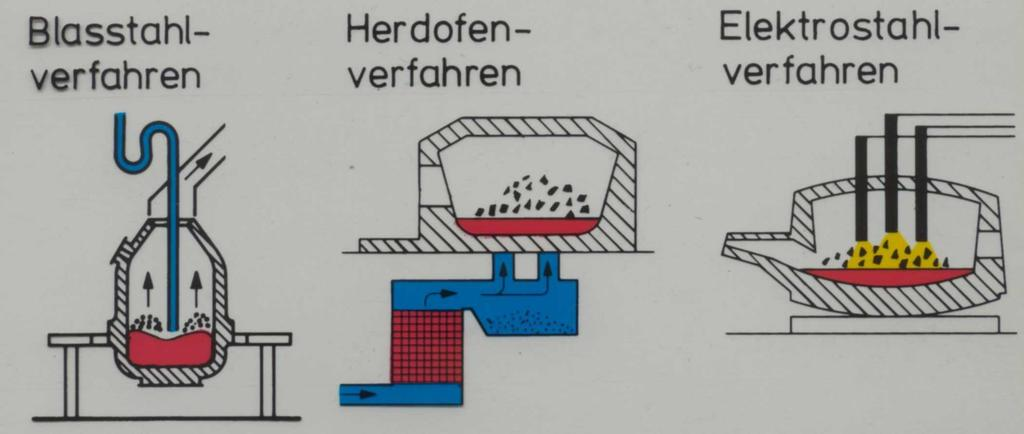
Alle Stahlgewinnungsverfahren müssen folgendes erreichen:
- Absenken des C-Gehaltes auf die gewünschten Werte.
- Entfernen von P und S, soweit wie es technisch und wirtschaftlich möglich ist.
- Erhitzen der Schmelze auf eine Gießtemperatur von ca. 1600°C.
Die Eisenbegleiter haben zum Sauerstoff eine größere Affinität als das Eisen selbst. Dadurch können sie bei Sauerstoffzufuhr aus dem flüssigen Roheisen herausgebrannt werden. Dieser Oxidationsvorgang wird von alters her Frischen genannt.
Das Ziel ist immer einen Stahl, welcher weitgehend frei von Verunreinigungen ist, mit möglichst homogener Qualität zu erreichen.
Chemische Vorgänge beim Frischen
Der Sauerstoff trifft zunächst auf das Eisen, das ja im Überschuß vorhanden ist, und bildet das Eisenoxid FeO. Es löst sich im Eisen und reagiert mit den Eisenbegleitern.
Sauerstoff geht vom Eisenoxid zu den Eisenbegleitern über. Das Eisen wird reduziert, die Eisenbegleiter oxidiert (Redox-Reaktionen).
Dieser Frischvorgang wird z.B in einem Konverter durchgeführt (convertere = umwandeln, verwandeln). Aus Roheisen wird Rohstahl. Im LD-Verfahren wird dabei wird Sauerstoff „aufgeblasen“.
Im Einzelnen spielen sich folgende chemische Vorgänge ab:
| Reaktion | Temperatursteigerung pro % Eisenbegleiter |
| 2 FeO + Si ⇌ 2 Fe + Si02 | 345 °C |
| FeO + Mn ⇌ Fe + MnO | 89 °C |
| FeO + C ⇌ Fe + CO | 23 °C |
| 2 FeO + S ⇌ 2 Fe + S02 | 41 °C |
| 5 FeO + 2 P ⇌5 Fe + P205 | 242 °C |
Da bei der Reaktion mit Sauerstoff die Temperatur stark ansteigt, muss mittels Zugabe von Schrott gekühlt werden. Das Aufheizen des Schrottes auf Schmelztemperatur und das Schmelzen des Stahlschrottes bewirkt diese „Kühlung“. Die Temperatur soll ca. 1600-1650°C für die Weiterverarbeitung z.B. die Sekundärmetallurgie oder den Strangguss betragen.
Strangguss ist immer ein beruhigter Stahlguss. Zum flüssigen Stahl werden vor dem Abgießen sogenannte „Beruhigungsmittel“ hinzugegeben.
- Sekundärmetallurgie
- beruhigter Stahlguss
- Teilmengenentgasung (Heberverfahren)
- Gießstrahlentgasung
- Pfannenofen
- Umschmelzverfahren
- Elektro-Schlacke-Umschmelzen (ESU)
- Vakuum-Lichtbogen-Umschmelzen
Letzter Schritt einer sekundärmetallurgischen Behandlung ist meistens das Reinheitsgradspülen. Z.B. wird über die Bodenspülung eine geringe Gasmenge (anfang eventuelle Stickstoff, zuletzt immer Argon) in die Schmelze eingeleitet. Die aufsteigenden Gasblasen fangen fein dispers in der Schmelze schwebende, nichtmetallische Partikel (z.B. Aluminiumoxid) ein, die mit den Gasblasen aufsteigen und in die Schlacke gelangen.
Bei der Herstellung und Raffination von Stahl entweichen die Elemente C, Zn, Pb, H, N und S als gasförmig (S teilweise als SO2) das Stahlbad. Si, Al, Ta, B, Mg, W, Ti und Nb gehen vollständig in die Schlacke (meist oxidisch). Mn, P, zum Teil S, Cr und V verteilen sich im „Metallbad“ und in der Schlacke. Cu, Ni, Sn, As, Bi, Sb, Se, Te und Co verbleiben im Metallbad.